|
Bei den bisher behandelten anorganischen Verbindungen hatten wir es i. d. R. mit festen Stoffen zu tun, bei denen die thermische Energie in den Vibrationen gespeichert wird und Translation und Rotation praktisch keine Rolle spielen. Bei den organischen Stoffen kommen jetzt Translation, Rotation und Vibration vor. Anders als bei den anorganischen Stoffen ist auch, dass bei organischen Verbindungen die thermodynamischen Angaben auf deutliche größere Fromeleinheiten bezogen werden. Es geht in dem folgenden Abschnitt darum, herauszuarbeiten, dass und wie sich die Speicherung der thermischen Energie auf Translations- und Rotationsniveaus anders gestaltet als bei der Vibration.
Zum Einstieg wählen wir die Monohalogenmethane als Einstiegsbeispiel aus. Bei diesen Halogenalkanen sind die Entropiewerte der Methanderivate im folgenden Diagramm ersichtlich:
|
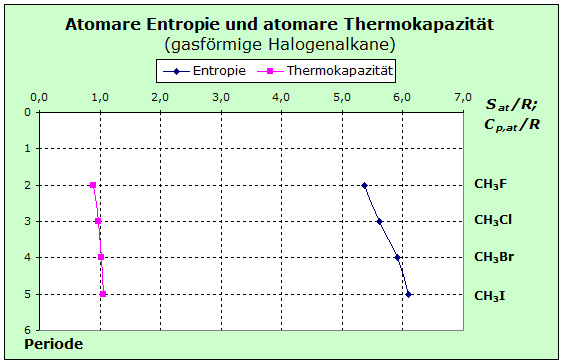 Ähnlich wie bei den anorganischen Stoffen er- kennt man hier, dass die Variation bei der Thermo- kapazität geringer ist als bei der Entropie. Da wir es hier mit gasförmigen Stoffen zu tun haben, liegt es nahe einen Blick auf die Werte bei den Edelgasen zu werfen. Aus der Tabelle in Abschnitt 3.3 entnimmt man, dass die Entropie- werte mit zunehmender Masse größer werden, während die Thermokapa- zitäten konstant bleiben. Die Teilchenmasse wirkt sich bei der Translation offenbar auf Entropie und Thermokapazität anders aus als bei der Vibration. Ähnlich wie bei den anorganischen Stoffen er- kennt man hier, dass die Variation bei der Thermo- kapazität geringer ist als bei der Entropie. Da wir es hier mit gasförmigen Stoffen zu tun haben, liegt es nahe einen Blick auf die Werte bei den Edelgasen zu werfen. Aus der Tabelle in Abschnitt 3.3 entnimmt man, dass die Entropie- werte mit zunehmender Masse größer werden, während die Thermokapa- zitäten konstant bleiben. Die Teilchenmasse wirkt sich bei der Translation offenbar auf Entropie und Thermokapazität anders aus als bei der Vibration.
|
Mit dem Programm Thermulation II kann man sich einen Überblick darüber verschaffen, dass eine größere Masse nur bei den Vibrationsspeichern zu einer größeren Speicherfähigkeit führt. Nur dort wird bei der (durch die größere Masse) größeren Entropie auch mehr thermische Energie bis zur gleichen Temperatur gespeichert.
Man findet mit diesem Programmm weiterhin, dass beim Ableiten der Translationsentropie nach ln(T) ein konstanter Beitrag von 2,5 R in den Translationsanteil der Thermokapazität eingeht. Für die Rotation ergibt sich entsprechend ein konstanter Beitrag von 1,0 R. Nur bei der Vibration wird bei steigender Masse zunehmend mehr thermische Energie bei größerer Entropie gespeichert und beim Ableiten der Vibrationsentropie nach ln(T) ergibt sich ein steigender Beitrag zum Vibrationsanteil der Thermokapazität.
Da beim Thermulation II Programm keine Realgaskorrektur durchgeführt wird, muss man jedoch zusätzlich bedenken, dass auch die Abweichung vom idealen Gas sich auf die Lage der Energieniveaus auswirken wird.
Mit diesen Hintergrundinformationen können wir jetzt das obige Diagramm näher betrachten und deuten. Bei den Halogenmethanmolekülen im Gaszustand kann die thermische Energie sowohl in Translations-, wie Rotations- und Vibrationsspeichern auftreten. Bei der Entropie werden deshalb mit der zunehmenden Masse der schwerer werdenden Halogenatome diese Werte auch in allen drei Bereichen ansteigen.
Bei der Thermokapazität erhalten wir für Translation und Rotation einen konstanten Beitrag von 3,5 R, der sich auf die jeweils 5 Atome der Moleküle mit 0,7 R verteilt. Für die Vibration bleiben ansteigende Werte von 0,2 - 0,36 R, mit denen sich die im Diagramm gezeigten Werte der atomaren Thermokapazität ergeben.
Die verschiedenen chemischen Bindungen, die wir in den Beispielen des obigen Diagramms finden, ermöglichen eine Deutung dieser geringen Unterschiede der Thermokapazitäten: Wegen der abnehmenden Elektronegativitätsdifferenz der Halogen-Kohlenstoff-Bindung sind diese Bindungen mit zunehmender Periode schwächer polar. Damit sind die Rückstellkräfte geringer und die zugehörigen Niveaus liegen dichter beieinander. Die Übergangsfrequenz bei der C - I Bindung ist gering und hier sind bereits bei Raumtemperatur deutlich mehr Niveaus besetzt sind als bei der C - F Bindung. Dies wirkt sich - zwar schwach, aber messbar - auf die Thermokapazität aus. Die atomaren Entropiewerte steigen von Periode zu Periode stärker an, weil Kraft- und Masseeffekt in allen drei Speichern in gleicher Richtung wirken: Die Kräfte werden kleiner, die Massen größer.
|
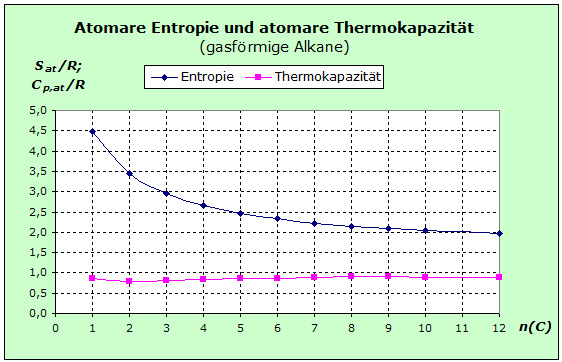 Zunächst fällt die deutliche Abnahme der Entropie mit zunehmender Kettenlänge der Alkane auf. Da alle Stoffe gasförmig sind, steht jedem Molekül prak- tisch das gleiche Durch- schnittsvolumen zur Verfü- gung. Zunächst fällt die deutliche Abnahme der Entropie mit zunehmender Kettenlänge der Alkane auf. Da alle Stoffe gasförmig sind, steht jedem Molekül prak- tisch das gleiche Durch- schnittsvolumen zur Verfü- gung.
Da jedoch die Moleküle mit zunehmender Kettenlänge mehr Atome enthalten, entfällt auf das einzelne Atom im Durchschnitt weniger Freiraum, weil das Eigenvolumen sämtlicher Moleküle vom Volumen des gesamten Raums abgezogen werden muss und weil sich den verbleibenden Raum immer mehr Atome teilen müssen. Die Atome werden auf einen kleineren Raum eingeengt. Nach der Kraftregel sinkt dadurch die Entropie, genauer die mittlere Entropie pro Atom.
|
Die Thermokapazität ist offensichtlich in der gesamten homologen Reihe konstant. Da alle Stoffe gasförmig sind, ergibt sich auch hier wieder der Sockelbeitrag zur Thermokapazität aus Translation und Rotation von 3,5 R. Allerdings wird dieser bei der Angabe der atomaren Werte innerhalb der homologen Reihe auf zunehmend mehr Atome verteilt und schlägt sich schwächer zu Buche. Da die Werte aber - wie das Diagramm zeigt - konstant sind, muss irgendwoher Ersatz kommen. Es liegt nahe, dass der Ausgleich aus der Vibration kommen könnte.
Die Übergangsfrequenzen bei den C-H und C-C Bindungen sind sehr hoch und werden bei Raumtemperatur kaum Auswirkungen auf Entropie und Thermokapazität haben. Mit zunehmender Kettenlänge wird es jedoch immer leichter diese Kette zu verformen. Deshalb bietet sich als Deutung an, dass die Deformationsschwingungen der C-Atom Ketten den Beitrag zur Thermokapazität liefern, der zur Konstanz dieser Werte führt.
Wenden wir uns nun den flüssigen organischen Stoffen zu. Das nächste Diagramm zeigt die Entropie- und Thermokapazitätswerte der Alkane, die ab einer Kettenlänge von 5 C-Atomen bei Raumtemperatur flüssig sind.
|
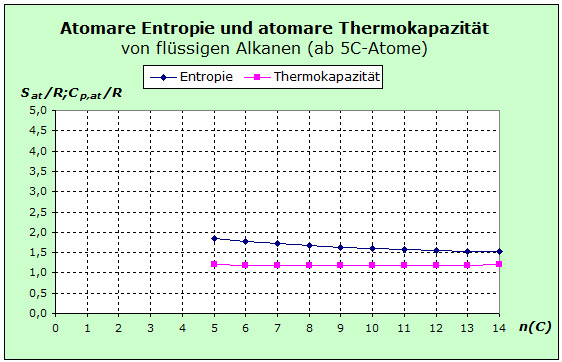 Im Vergleich mit den gasförmigen Alkanen er- kennt man, dass beide Kurven deutlich näher beieinander liegen. Die Entropiewerte liegen etwa 0,5 R niedriger und die Thermokapazitäten um 0,4 R höher als bei den gasförmigen Alkanen. Im Vergleich mit den gasförmigen Alkanen er- kennt man, dass beide Kurven deutlich näher beieinander liegen. Die Entropiewerte liegen etwa 0,5 R niedriger und die Thermokapazitäten um 0,4 R höher als bei den gasförmigen Alkanen.
Gleich ist jedoch, dass die Entropiekurven in beiden Diagrammen abnehmend verlaufen, während die Thermokapazitäten sehr gut konstant bleiben.
Gehen wir also der Frage nach, was in Flüssigkeiten in Bezug auf Translation, Rotation und Vibration anders ist als im Gaszustand.
|
Aus dem Diffusions Phänomen schließen wir, dass die Teilchen in der Flüssigkeit nach wie vor irgendeine Art der Translation durchführen können. Da jedoch die Freiräume dafür deutlich kleiner sind als im Gaszustand, liegen die Translationsniveaus weiter auseinander und führen zu einer geringeren Entropie. Selbst wenn wir für die Thermokapazität wieder den Sockelbetrag von 2,5 R annehmen, so wird dieser Einfuss mit zunehmender Kettenlänger stetig abnehmen und schließlich marginal werden. Denn bereits bei dem ersten Stoff dieser Reihe, dem Pentan, wird der Sockelbetrag auf 17 Atome verteilt.
Sicherlich drehen sich polare Moleküle in einer Flüssigkeit beim Aufbau einer Solvathülle. Ob sie allerdings ebenso frei rotieren wie im Gaszustand, können wir so einfach nicht behaupten. Für die Thermokapazität können wir jedoch schon sagen, dass die Rotation vernachlässigbar sein wird, weil sich der Beitrag von nur 1,0 R auf 17 und mehr Atome verteilen würde. Für die Rotationsentropie erscheint es plausibel anzunehmen, dass die Rotation bei zunehmender Kettenlänge immer schwieriger wird und immer weniger Rotationsniveaus besetzt sein werden. Als Folge wird die abnehmende Rotationsentropie auch die geringeren Werte im Kurvenverlauf verständlich machen.
Bei der Vibration haben wir zu berücksichtigen, dass außer den kovalenten Bindungen in den Molekülen noch van-der-Waals-Bindungen zwischen den Molekülen hinzugekommen sind. Die Teilchen nähern sich bis auf einen gewissen Abstand an, aber die Flüssigkeit kollabiert nicht, sondern es kommt zu einem Gleichgewicht mit entsprechenden Rückstellkräften. Also treten neuartige Vibrationen auf, die wir in die Überlegungen einbeziehen müssen. Wegen des geringeren Einfusses von Translation und Rotation verläuft die Entropiekurve niedriger als bei den gasförmigen Alkanen. Die Kettendeformationen und die Übergänge der neuen van-der-Waals Bindungen liefern weitere Beiträge zum Entropieverlauf. Diese neue Speichermöglichkeit sorgt bei der Thermokapazität für den Kurvenverlauf bei insgesamt höheren Werten als beiden gasförmigen Alkanen.
|
Nachdem wir in diesem Kapitel beispielhaft mit einigen Elementen, anorganischen und organischen Stoffen beschäftigt haben, können wir eine erste Zusammenfassung formulieren.
-
Thermische Energie wird vorwiegend auf den Energieniveaus von Translation, Rotation und Vibration gespeichert. Elektronenzustände in der Atomhülle können zwar auch noch thermische Energie speichern, aber unter Standardbedingungen sind diese Speicher zumeist nicht merklich angefüllt. Aus diesem Grunde werden sie hier zunächst nicht behandelt.
-
Im festen Zustand sind die Vibrationsspeicher von dominanter Bedeutung. Der Zusammenhalt in diesem Zustand geht von den chemischen Bindungen aus, die die stofflichen und thermischen Eigenschaften prägen. Kraft- und Masseregel bestimmen nicht nur die Entropie sondern auch die bis zu einer bestimmten Temperatur gespeicherte thermische Energie. Bei kleinen Niveauabständen, also bei kleinen Rückstellkräften und/oder großen Teilchenmassen, wird bei gleicher Temperatur mehr thermische Energie gespeichert.
-
Im flüssigen Zustand werden zusätzlich Energieniveaus von Translation und Rotation besetzt und bestimmen zusammen mit den Niveaus der chemischen Bindung die stofflichen Eigenschaften. Kraft- und Masseregel bestimmen auch bei Translation und Rotation die Entropie, aber auf diesen Niveaus wird bei größerer Entropie nicht mehr Energie gespeichert.
-
Im gasförmigen Zustand übernehmen die Translations- und Rotationsspeicher die dominante Bedeutung. Bei steigender Temperatur treten die Vibrationen als weitere Speichermöglichkeit hinzu.
-
Die einatomigen Gase, wie z. B. die Edelgase nehmen eine Sonderrolle ein. Die thermische Energie kann nur in Translationsniveaus gespeichert werden, weil einzelne Atome nicht rotieren oder schwingen können. Bei gleicher Temperatur speichern die Edelgase bei gleicher Temperatur gleichviel thermische Energie, obwohl die schwereren Gase dabei eine größere Entropie haben.
|
 Ähnlich wie bei den anorganischen Stoffen er- kennt man hier, dass die Variation bei der Thermo- kapazität geringer ist als bei der Entropie. Da wir es hier mit gasförmigen Stoffen zu tun haben, liegt es nahe einen Blick auf die Werte bei den Edelgasen zu werfen. Aus der Tabelle in Abschnitt 3.3 entnimmt man, dass die Entropie- werte mit zunehmender Masse größer werden, während die Thermokapa- zitäten konstant bleiben. Die Teilchenmasse wirkt sich bei der Translation offenbar auf Entropie und Thermokapazität anders aus als bei der Vibration.
Ähnlich wie bei den anorganischen Stoffen er- kennt man hier, dass die Variation bei der Thermo- kapazität geringer ist als bei der Entropie. Da wir es hier mit gasförmigen Stoffen zu tun haben, liegt es nahe einen Blick auf die Werte bei den Edelgasen zu werfen. Aus der Tabelle in Abschnitt 3.3 entnimmt man, dass die Entropie- werte mit zunehmender Masse größer werden, während die Thermokapa- zitäten konstant bleiben. Die Teilchenmasse wirkt sich bei der Translation offenbar auf Entropie und Thermokapazität anders aus als bei der Vibration. Zunächst fällt die deutliche Abnahme der Entropie mit zunehmender Kettenlänge der Alkane auf. Da alle Stoffe gasförmig sind, steht jedem Molekül prak- tisch das gleiche Durch- schnittsvolumen zur Verfü- gung.
Zunächst fällt die deutliche Abnahme der Entropie mit zunehmender Kettenlänge der Alkane auf. Da alle Stoffe gasförmig sind, steht jedem Molekül prak- tisch das gleiche Durch- schnittsvolumen zur Verfü- gung. Im Vergleich mit den gasförmigen Alkanen er- kennt man, dass beide Kurven deutlich näher beieinander liegen. Die Entropiewerte liegen etwa 0,5 R niedriger und die Thermokapazitäten um 0,4 R höher als bei den gasförmigen Alkanen.
Im Vergleich mit den gasförmigen Alkanen er- kennt man, dass beide Kurven deutlich näher beieinander liegen. Die Entropiewerte liegen etwa 0,5 R niedriger und die Thermokapazitäten um 0,4 R höher als bei den gasförmigen Alkanen.