6.2. Thermisches Gleichgewicht
|
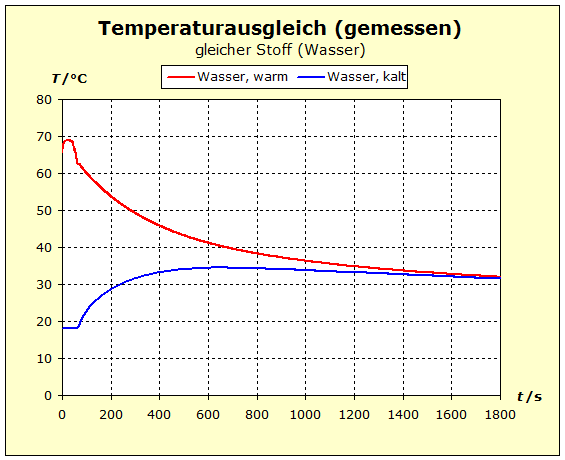
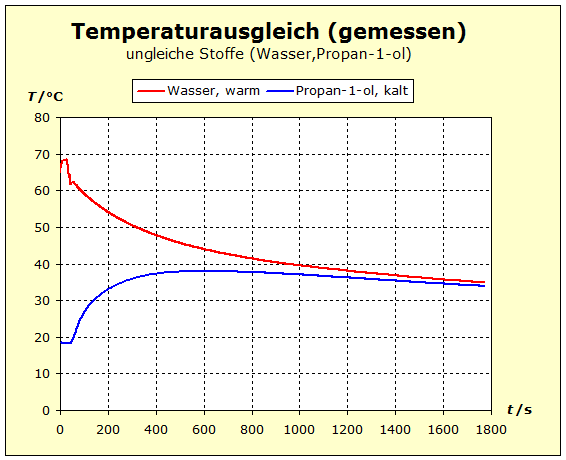
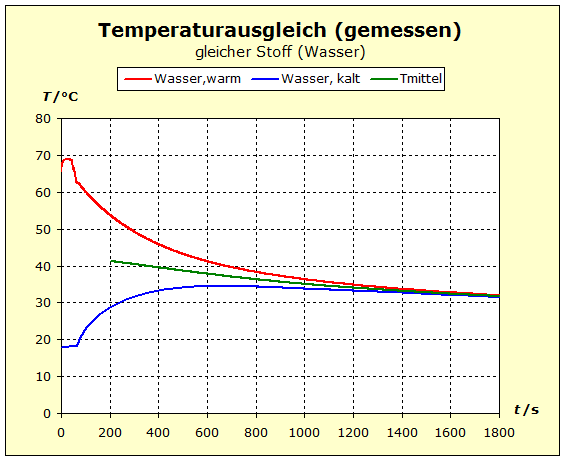
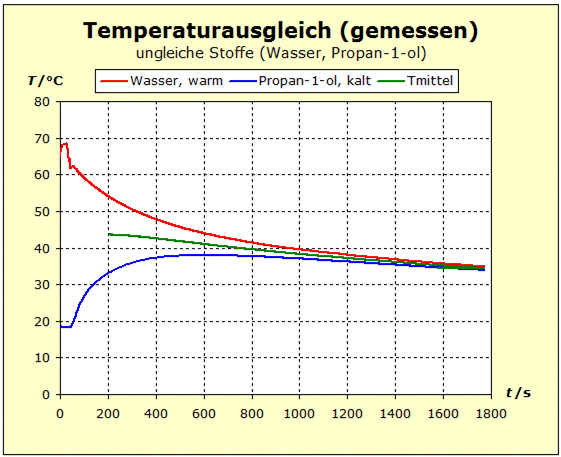
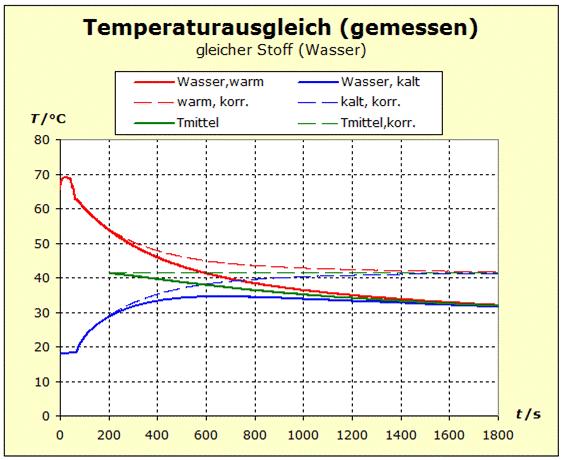
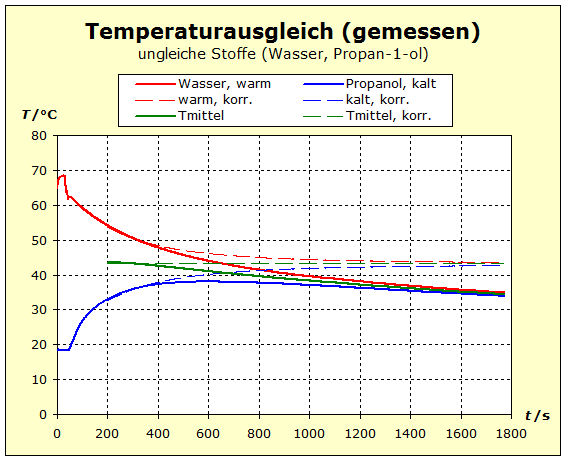
6.2.1. Temperaturausgleich Bringt man zwei (oder mehr) Stoffe in thermischen Kontakt, so beobachten wir, dass spontan ein bestimmter Prozess einsetzt, der "automatisch" zu einem bestimmten Endzustand führt. Dieser Zustand ist stets dadurch gekennzeichnet, dass alle beteiligten Stoffe die gleiche Temperatur annehmen. Für den täglichen Umgang ist es von Interesse, zu verstehen, wodurch bestimmt wird, wo diese Endtemperatur liegt - näher bei der Temperatur des heißesten oder des kältesten Stoffs. |
|
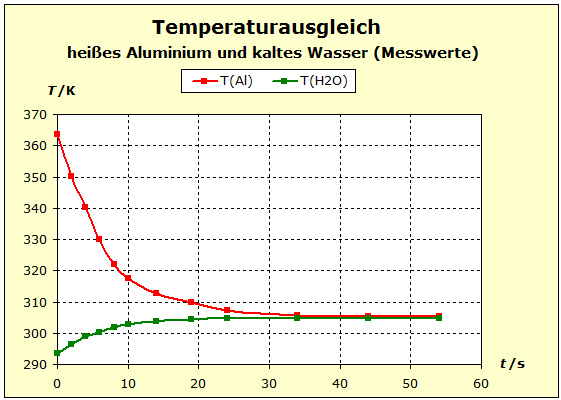
Video: Temperaturausgleich zwischen heißem Aluminium und kaltem Wasser Das heiße Aluminium hat sehr viel von seiner anfänglichen Temperatur verloren, während sich das kalte Wasser kaum erwärmt hat. Wasser ist offensichtlich ein thermisch träger Stoff, er ändert seine Temperatur nur geringfügig. |
Wir wiederholen den vorigen Versuch aber nehmen diesmal als Metall einen heißen Kupferblock. Wir wollen sehen, ob das edlere Metall Kupfer in der Lage sein wird, seine thermische Energie besser bei sich zu behalten als das Aluminium. Das wäre dann der Fall, wenn die Endtemperatur im folgenden Experiment höher liegt als beim Temperaturausgleich zwischen Aluminium und Wasser.
Video: Temperaturausgleich zwischen heißem Kupfer und kaltem Wasser 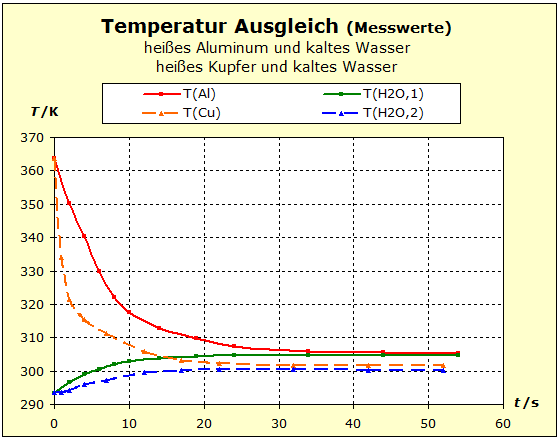 Beim Entauchen in das kalte Wasser haben die beiden Metalle mit 91°C (364K) etwa die gleiche Ausgangstemperatur und das Wasser ist etwa 20°C (293K) "kalt". Man erkennt aber auch einen Unterschied in der thermischen Trägheit zwischen Aluminium und Kupfer: beim Aluminium wird die Temperatur um etwa 4 K weniger abgesenkt als beim Kupfer. Der Aluminiumblock verhält sich thermisch also träger als der Kupferblock. Die Temperatur des Wassers steigt beim Aluminium stärker als beim Kupfer: ΔT(Wasser,Al) ≈ 11 K; ΔT(Wasser,Cu) ≈ 7 K. Deshalb kann man schließen, dass der Aluminiumblock an der Wasserportion deutlich mehr (ca. 60%) thermische Arbeit verrichtet als der Kupferblock. S/R(Al)= 3,41 S/R(Cu)= 3,99 Für die Thermokapazitäten findet man: Cp/R(Al)= 2,93 Cp/R(Cu)= 2,94 Die Thermokapazität des Kupfer ist also nur sehr geringfügig größer als die des Aluminiums, so dass man auch nach diesem Befund feststellt, dass die thermische Trägheit des Aluminiums in obigem Experiment der großen Anzahl der Atome geschuldet ist. In den Abschnitten 3.3 und 3.4 wurden bereits Diagramme gezeigt, die systematisch für die Stoffe im Periodischen System der Elemente zeigen, dass die Thermokapazitäten sich zwar gleichartig, aber wesentlich geringer ändern als die molaren Standardentropien. * Da die Metalle nicht aus Molekülen bestehen haben die molaren Entropien dieselben Zahlenwerte wie die atomaren Entropien. |
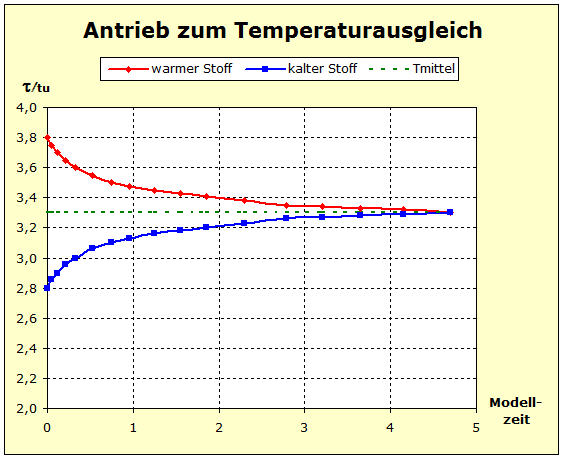
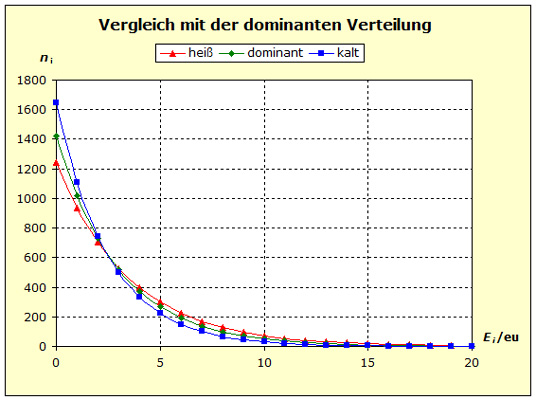
Auf der Modellebene lassen sich die in den vorigen Experimenten gezeigten Phänomene auf verschiedene Arten darstellen. In den beiden nächsten Videos wird das Fluidmodell mit Getränkeflaschen als Modellversuch eingesetzt und dabei der Temperaturausgleich zwischen Aluminium und Wasser, bzw. Kupfer und Wasser nachvollzogen. Es kommt in beiden Fällen zu einer Endtemperatur, die näher bei der Anfangstemperatur des Stoffes mit der größeren Standardentropie liegt. |
|
Video: Modellversuch zum Temperaturausgleich zwischen Aluminium und Wasser |
Video: Modellversuch zum Temperaturausgleich zwischen Kupfer und Wasser 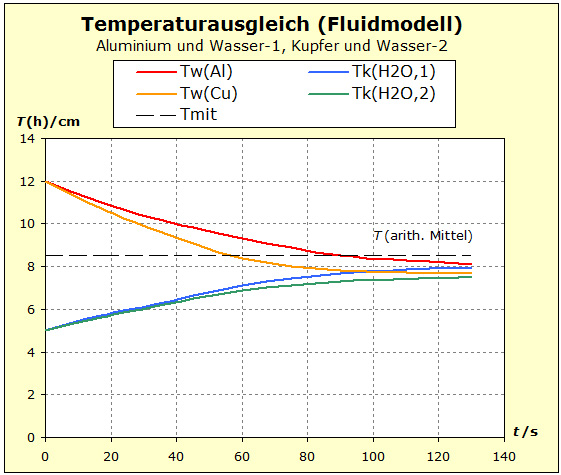 Man erkennt aus dem Diagramm sehr gut, dass die thermische Trägheit beim Wasser am größten ist und dass das Aluminium in der thermischen Trägheit aber das Kupfer übertrifft, weil die Temperatur des Aluminiums nicht so stark abgesenkt wird wie die des Kupfers. |
Das Fluidmodell erlaubt auch eine starke Vereinfachung, indem auf eine räumliche Darstellung des zylindrischen Speichergefäßes verzichtet wird. Dennoch erkennt man die wesentlichen Eigenschaften der dargestellten Stoffe, wie Entropie/Querschnitt und Temperatur/Füllhöhe. Der folgende Link verdeutlicht dies. |
PDF: Temperaturausgleich zweier Stoffe mit unterschiedlicher Standardentropie |
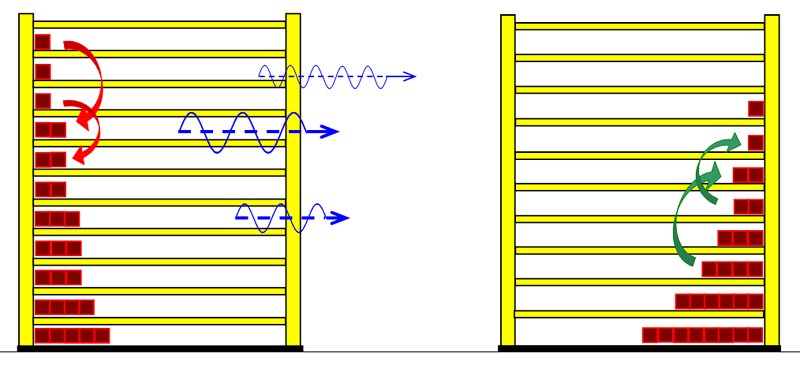
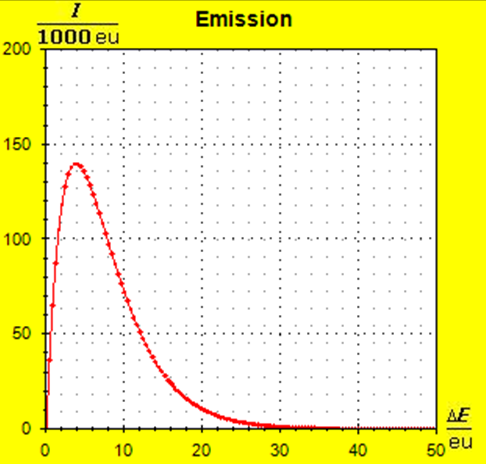
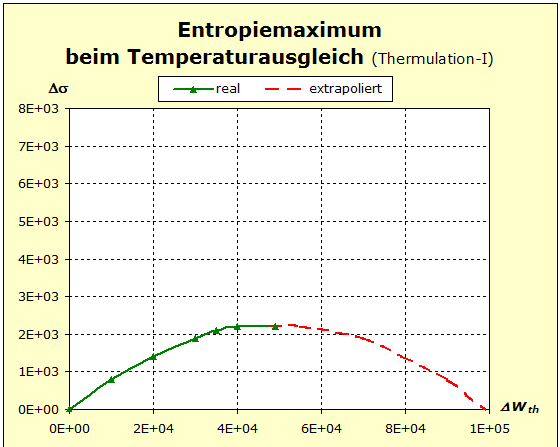
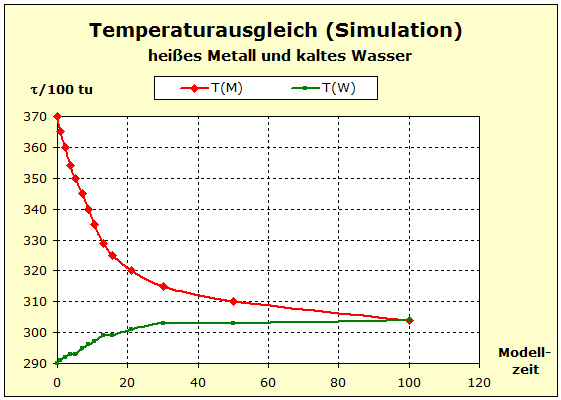
Möchte man jedoch die Zusammenhänge möglichst umfassend beschreiben, so wird man auf die quantentheoretischen Grundlagen zurückgreifen müssen. Dies ist mit dem Programm Thermulation-I auch leicht zu verwirklichen. Die folgende Animation zeigt einen Temperaturausgleich zwischen zwei verschiedenen Stoffen wie z. B. Metall und Wasser, wobei auch unterschiedliche Atomanzahlen und die quantentheoretischen Hintergründe dieses Prozesses berücksichtigt werden können. Die Simulation bildet den Vorgang des Temperaturausgleichs zwischen Kupfer und Wasser ab, so wie er im obigen Realexperiment durchgeführt wurde.
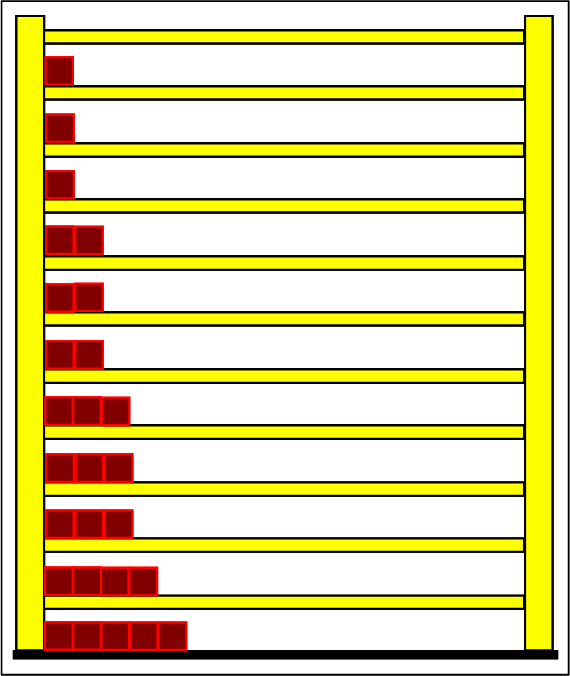
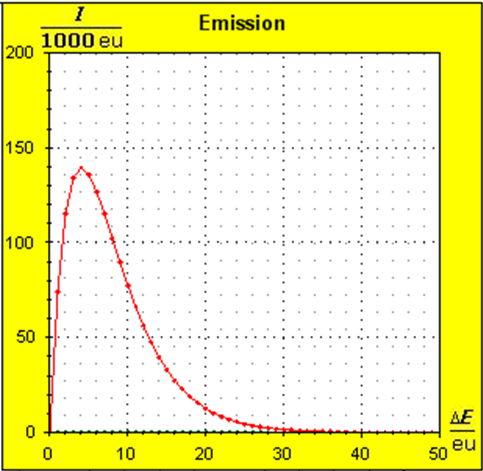
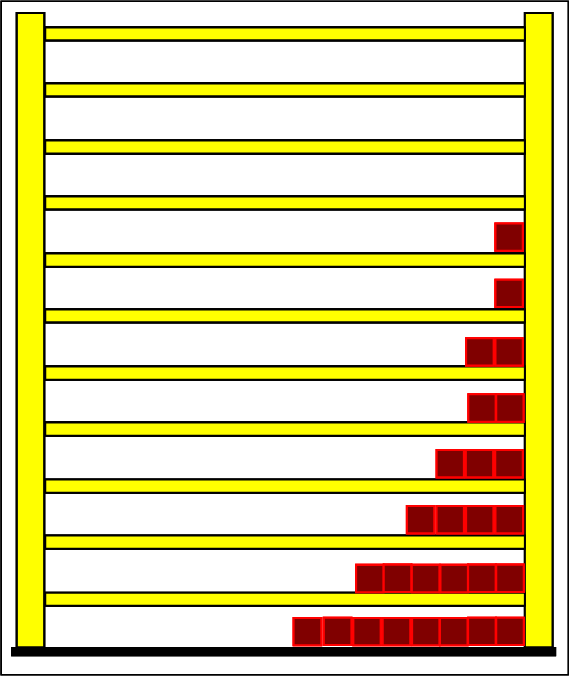
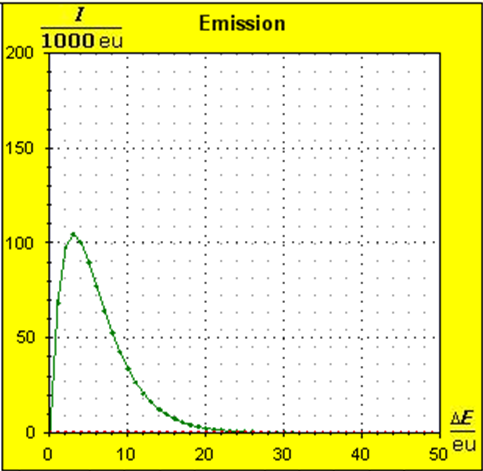
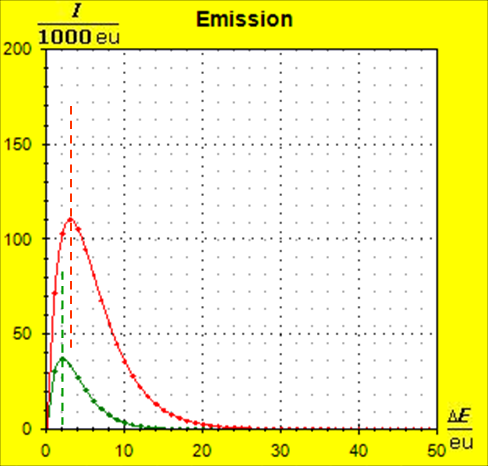
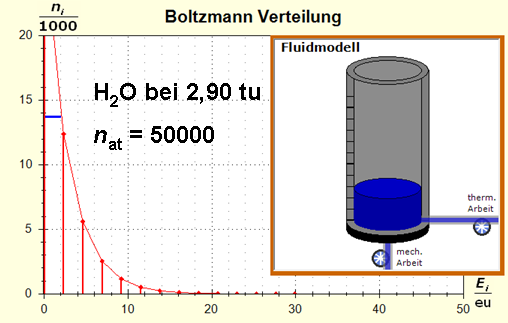
Schritt 1: Schritt 2: Sat(Al):Sat(H2O)= 28,33:23,30=1,22:1. Auf der Modellebene müssen wir jetzt für Wasser und Aluminium zwei Energieniveauabstände suchen, die bei gleichen Atomanzahlen zu Entropiewerten führen, die an dieses Werteverhältnis gut angepasst sind. Die Werte ΔE(Al) = 1,7 eu und ΔE(H2O) = 2,3 eu erfüllen diese Bedingung auf der Modellebene in Modelleinheiten gut und zwar für jeweils ca. 50000 Teilchen: σ(A):σ(B)= 79000 : 64100 = 1,23 : 1 Diese Wahl ist zunächst willkürlich, denn man könnte sicherlich auch mit zwei anderen Niveauabständen ein angemessenes Entropieverhältnis auf der Modellebene finden. Wir wollen erreichen, dass die Werte im Boltzmann-Diagramm und beim Fluidmodell zu guten Visualisierungen führen. Deshalb wenden wir uns jetzt den weiteren Randbedingungen zu, die die realen Stoffe vorgeben und beurteilen dann am Ende, ob diese Wahl geschickt war. Die beiden folgenden Bilder zeigen die Standardwerte der beiden modellierten Stoffe. Die beiden blauen Halbwertsenergielinien sind sichtbar gleich lang und die Temperaturskalen am Fluidzylinder zeigen die gleiche Füllhöhe an. 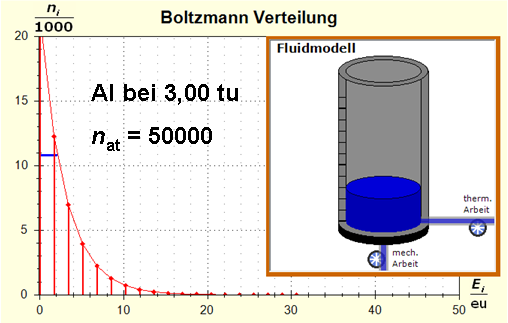
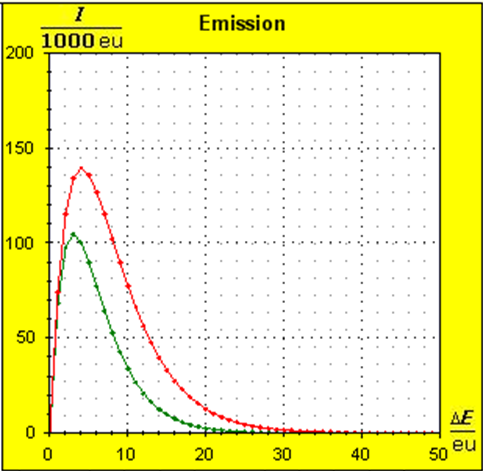
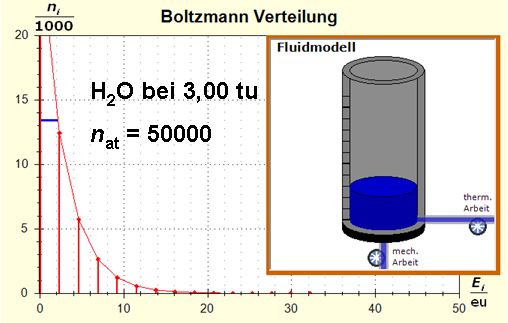 Man erkennt gut, dass Aluminium wegen der 4,5 mal so großen mitteren Atommasse die enger liegenden Niveaus hat. Wegen des größeren Querschnitts des Fluidspeichers, würde man bisher die größere thermische Trägheit beim Aluminium erwarten. Schritt 3: 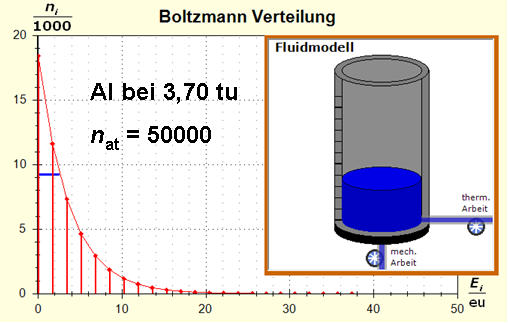
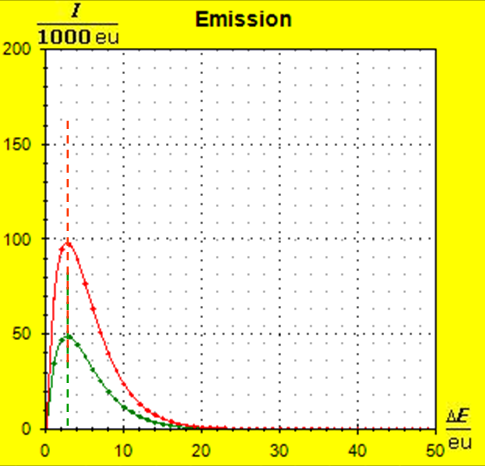
 Wegen der größeren Temperatur im Aluminium (erkennbar an der längeren blauen Halbwertsenergielinie und der größeren Füllhöhe) hat der Querschnitt, also die Entropie im Fluidmodell nochmal zugenommen und die thermische Trägheit vergrößert. Im Wasser erscheint die thermische Trägheit durch Absenkung der Temperatur noch etwas abgenommen zu haben. Schritt 4: Al : 100g : 26,98 g/mol = 3,71 mol = 3,71 . 6e+23 Atome = 2,22e+24 H2O : 100g : 6,00 g/mol = 16,7 mol = 16,7 . 6e+23 Atome = 1,00e+25 Diese Werte übertragen wir in ihrer Relation auf die Modellebene, indem wir für Wasser die im Programm vorgesehene Anzahl von 50000 und für Aluminium 11100 Atome wählen. Jetzt endlich erhalten wir die tatsächliche Ausgangssituatiuon für unser Modellexperiment: 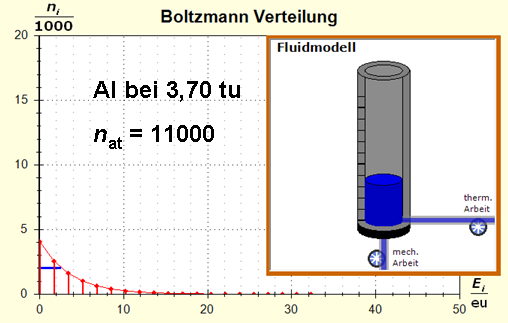
 Jetzt hat sich das Bild entscheidend geändert: Durch die kleine Stoffportion des Aluminiums ist die Entropie und damit die thermische Trägheit dieser Metallportion deutlich gesunken. Schritt 5: |
|
Animation: Temperaturausgleich zwischen Aluminium und Wasser |
|
Schritt 6: |
|
 |
 |
|
|
 zu 3. : Wir wollen die beiden Wasserportionen nicht durch Umrühren miteinander vermischen und verwenden deshalb ein Kalorimeter mit einer Zwischenwand, so wie man es in thermdynamischem Kontext häufig auch in Lehrbüchern findet. Der quantentheoretische Hintergrund ist der Folgende: Energie wird von den hochliegenden Energieniveaus des heißeren Stoffs auf die niedrigeren Energieniveaus des kalten Stoff übertragen. Es ändern sich also in beiden Stoffportionen die Anzahl der besetzten Niveaus und damit die Entropie. Um eine Diskussion zu vermeiden über das, was die klassische Thermodynamik als Mischungsentropie bezeichnet, sollen hier die Wasserportionen nicht vermischt werden. Der thermische Kontakt wird über eine dünne Kunststofftrennwand hergestellt. Dadurch ergibt sich eine niedrige Prozessgeschwindigkeit. Bei zwei gleichen Stoffen würde wohl auch klassisch keine Mischungsentropie auftreten, wenn wir hier trotzdem die Mischungsfrage ausklammern, so können wir denselben Versuchsaufbau auch für andere Stoffkombinationen verwenden. Zum quantentheoretische Hintergrund gehört auch ein weiterer Aspekt: Die Entropie setzt sich aus verschiedenen Anteilen zusammen und wird über die Verteilungsfunktionen (partition function, Zustandssumme) der Translation, Rotation, Vibration und der Elektronenzustände ermittelt. Eine 'partition function of mixture' ist jedoch in der Literatur nicht beschrieben.
zu 3. : Wir wollen die beiden Wasserportionen nicht durch Umrühren miteinander vermischen und verwenden deshalb ein Kalorimeter mit einer Zwischenwand, so wie man es in thermdynamischem Kontext häufig auch in Lehrbüchern findet. Der quantentheoretische Hintergrund ist der Folgende: Energie wird von den hochliegenden Energieniveaus des heißeren Stoffs auf die niedrigeren Energieniveaus des kalten Stoff übertragen. Es ändern sich also in beiden Stoffportionen die Anzahl der besetzten Niveaus und damit die Entropie. Um eine Diskussion zu vermeiden über das, was die klassische Thermodynamik als Mischungsentropie bezeichnet, sollen hier die Wasserportionen nicht vermischt werden. Der thermische Kontakt wird über eine dünne Kunststofftrennwand hergestellt. Dadurch ergibt sich eine niedrige Prozessgeschwindigkeit. Bei zwei gleichen Stoffen würde wohl auch klassisch keine Mischungsentropie auftreten, wenn wir hier trotzdem die Mischungsfrage ausklammern, so können wir denselben Versuchsaufbau auch für andere Stoffkombinationen verwenden. Zum quantentheoretische Hintergrund gehört auch ein weiterer Aspekt: Die Entropie setzt sich aus verschiedenen Anteilen zusammen und wird über die Verteilungsfunktionen (partition function, Zustandssumme) der Translation, Rotation, Vibration und der Elektronenzustände ermittelt. Eine 'partition function of mixture' ist jedoch in der Literatur nicht beschrieben.